Decode VRL
Erfahren sie mehr über die Studienziele und das vitreoretinale Lymphom
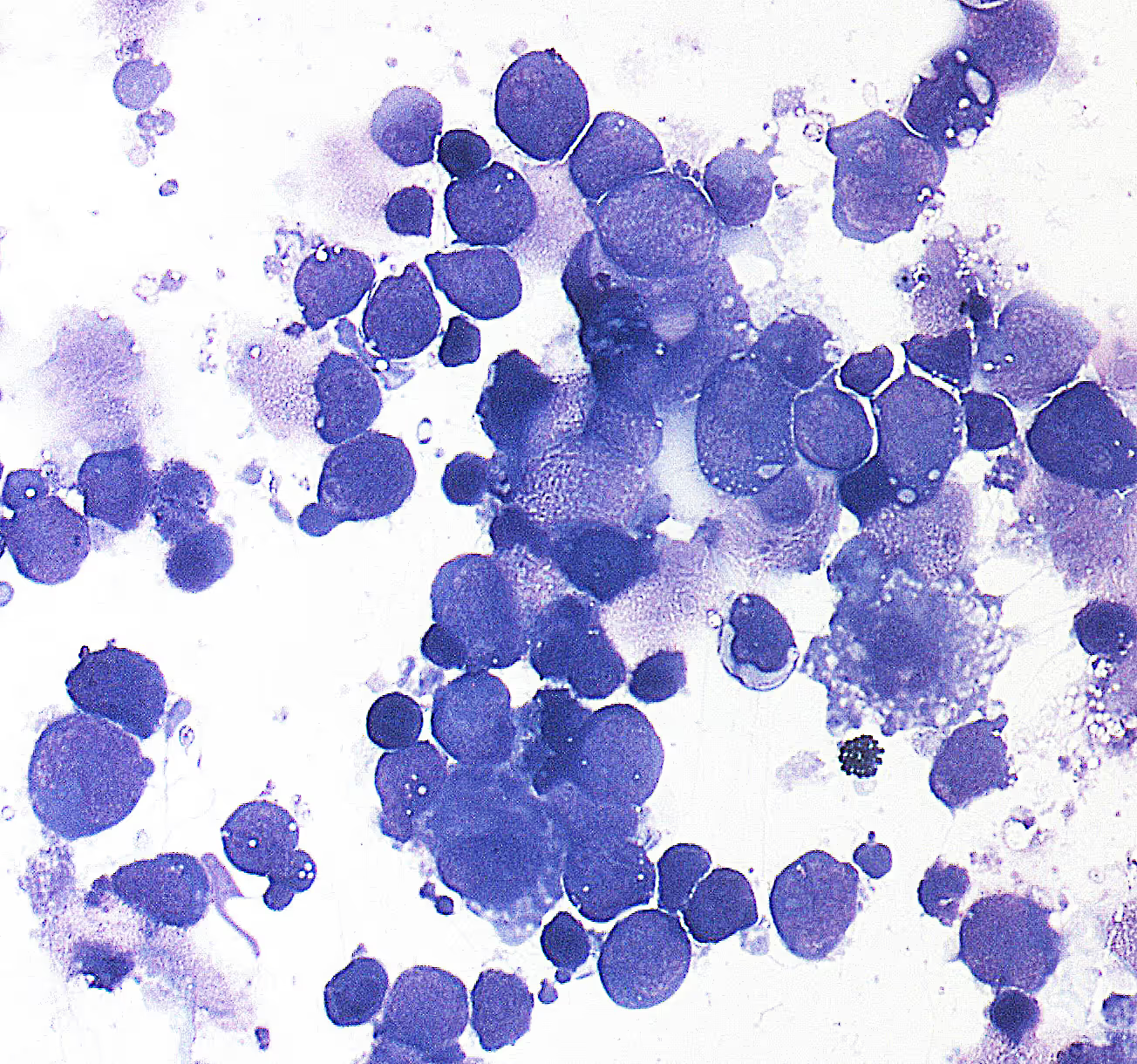
Das vitreoretinale Lymphom (VRL) ist eine seltene und aggressive Form des B-Zell-Lymphoms, das typischerweise das Augeninnere (Vitreoretinalraum) betrifft und häufig mit einem primären ZNS-Lymphom (PCNSL) assoziiert ist. Die Erkrankung, meist bei älteren Erwachsenen auftretend, ist mit einer niedrigen Überlebensrate assoziiert, insbesondere wenn die Diagnose verzögert erfolgt. Aufgrund der Seltenheit des VRL und der oft unspezifischen Symptome, die sich klinisch mit entzündlichen Augenerkrankungen überschneiden, wird VRL häufig erst spät erkannt, was eine frühzeitige Behandlung erschwert und die Prognose beeinträchtigt.
VRL ist diagnostisch schwer zu erfassen, da die Symptome oft denen der Uveitis, einer Entzündung der mittleren Augenhaut, ähneln. Patienten klagen häufig über verschwommenes Sehen und Augenbeschwerden, die sich bei Routineuntersuchungen zunächst als Entzündung darstellen. Standarddiagnosen wie die optische Kohärenztomographie (OCT) und Fluoreszenzangiographie können entzündliche und neoplastische Erkrankungen des Auges nicht zuverlässig unterscheiden. Zudem ist die Gewinnung diagnostischen Materials aufwändig, da die Gewebeentnahme aus dem Glaskörper (Vitrektomie) eine invasive Methode ist und oft nur geringe Mengen an Zellen liefert, was die diagnostische Sensitivität mindert.


Die DECODE VRL Studie ist notwendig, weil die derzeitigen Diagnosemethoden nur begrenzte Genauigkeit bieten und die Diagnose von VRL häufig Monate bis Jahre verzögert wird. Die bisherige Diagnosekette für VRL umfasst mehrere Schritte, die alle Schwierigkeiten und potenzielle Fehlerquellen bergen.
Die zytologische Untersuchung des Glaskörpers, bei der Zellen auf neoplastische Veränderungen untersucht werden, ist oft ungenau, da VRL-Zellen degenerative Veränderungen aufweisen und die Sensitivität niedrig ist. Zudem fehlt es an standardisierten Protokollen für molekularbiologische Untersuchungen, was zu stark variierenden Ergebnissen in verschiedenen Kliniken führt.
Gezielte Analyse genetischer Veränderungen:
Das VRL wird als Variante des diffus großzelligen B-Zellymphoms des ZNS (PCNSL) gesehen, das genetisch zur MCD/Cluster-5 Subgruppe des DLBCL gehört. Mittels eines spezifisch entwickelten Genpanels unter Einschluss von Kopienzahlveränderungen, Mutationen und miRNAs (19b, 21 und 92) wird eine hochsensitive und spezifische Diagnostik ermöglicht. Darüber hinaus sollen Risikofaktoren für den sekundären ZNS-Befall analysiert werden.
Evaluation der “liquid biopsy”:
Die Untersuchung zellfreier DNA aus dem Glaskörper oder einem Vorderkammeraspirat besitzt hohes Potential für eine minimal invasive molekulare Diagnostik insbesondere für Verlaufsuntersuchungen und wird daher im Rahmen der Studie parallel am Überstand des Vitrektomiepräparats evaluiert.
Next Generation Sequencing (NGS)-basierte Klonalitätsanalyse:
Die konventionelle Analyse der B-Zellklonalität zeigt aufgrund von somatischer Hypermutation der Immunglobulingene und des immunprivilegierten Status des Innenauges eine eingeschränkte Sensitivität und Spezifität. Die von unserer Arbeitsgruppe wesentlich vorangetriebene NGS-basierte Analyse der Klonalität von B-Zellen ermöglicht im Vergleich zu Standardmethoden eine genaue Quantifizierung klonaler Rearrangements und erlaubt eine Verfolgung des malignen Klons im Verlauf. Diese Methode hat eine höhere Sensitivität und Spezifität und ist besonders geeignet für zellarme Proben, wie sie in der Vitrektomie oft vorliegen.

Die DECODE VRL Studie ist eine Diagnostikstudie, die als prospektive, multizentrische Studie aufgebaut ist und an der bis zu 20 spezialisierte Augenkliniken in Deutschland als probenentnehmende Zentren teilnehmen. Die Studie hat eine geplante Laufzeit von insgesamt sechs Jahren und umfasst eine vierjährige Rekrutierungsphase sowie eine zweijährige Nachverfolgungsphase der Patienten. Die wichtigsten Schritte im Studienablauf umfassen:
Die DECODE VRL Studie wird nicht nur zur Verbesserung der Diagnostik beitragen, sondern auch eine Plattform für zukünftige Forschung und klinische Studien schaffen. Eine zentrale Biobank, in der verbleibende Glaskörperproben gelagert werden, wird für weitere Forschungszwecke zur Verfügung stehen. Dies ermöglicht es Wissenschaftlern, neue Biomarker und Therapieansätze zu erforschen. Langfristig soll das durch die DECODE VRL Studie etablierte Netzwerk als Basis für multizentrische klinische Studien und innovative Therapien für VRL und andere Augentumoren dienen.
Durch die Integration eines nationalen Registers werden darüber hinaus die klinischen Daten zu VRL-Patienten gesammelt und analysiert, was wertvolle Einsichten in die epidemiologischen und klinischen Verläufe der Krankheit geben könnte.
1: Elbert M, Neumann F, Kiefer M, Christofyllakis K, Balensiefer B, Kos I,Carbon G, Kaddu-Mulindwa D, Bittenbring JT, Fadle N, Regitz E, Fend F, BonzheimI, Thurner L, Bewarder M. Hyper-N-glycosylated SEL1L3 as auto-antigenic B-cellreceptor target of primary vitreoretinal lymphomas. Sci Rep. 2024 Apr26;14(1):9571. doi: 10.1038/s41598-024-60169-5. PMID: 38671086;
2: Bonzheim I, Salmerón-Villalobos J, Süsskind D, Szurman P, Gekeler F, SpitzerMS, Salaverria I, Campo E, Coupland SE, Quintanilla-Martinez L, Fend F.Molekulare Diagnostik des vitreoretinalen Lymphoms [Molecular diagnostics forvitreoretinal lymphoma]. Pathologie (Heidelb). 2023 Dec;44(Suppl 3):150-154.German. doi: 10.1007/s00292-023-01251-z. Epub 2023 Nov 10. PMID: 37947807.
3: Schiemenz C, Lüken S, Klassen AM, Ranjbar M, Illerhaus G, Fend F, Heindl LM,Chronopoulos A, Grisanti S, Kakkassery V. Klinisches Vorgehen bei intraokulärenLymphomen [Clinical procedures for intraocular lymphomas]. Ophthalmologie. 2022Jul;119(7):675-685. German. doi: 10.1007/s00347-022-01651-1. Epub 2022 Jun 9.PMID: 35925411.
4: Fend F, Bonzheim I, Kakkassery V, Heindl LM, Illerhaus G. Lymphome des Augesund seiner Adnexe : Moderne pathologische Diagnostik und systemische Therapie[Lymphoma of the eye and its adnexa : Modern pathological diagnostics andsystemic treatment]. Ophthalmologie. 2022 Jul;119(7):664-674. German. doi:10.1007/s00347-022-01650-2. Epub 2022 May 23. PMID: 35925409.
5: Bonzheim I, Sander P, Salmerón-Villalobos J, Süsskind D, Szurman P, GekelerF, Spitzer MS, Steinhilber J, Kohler E, Büssgen M, Schittenhelm J, Salaverria I,Campo E, Coupland SE, Quintanilla-Martinez L, Fend F. The molecular hallmarks ofprimary and secondary vitreoretinal lymphoma. Blood Adv. 2022 Mar 8;6(5):1598-1607. doi: 10.1182/bloodadvances.2021004212. PMID: 34448823; PMCID:PMC8905692.
6: Sobolewska B, Chee SP, Zaguia F, Goldstein DA, Smith JR, Fend F, Mochizuki M, Zierhut M. Vitreoretinal Lymphoma. Cancers (Basel). 2021 Aug 4;13(16):3921. doi: 10.3390/cancers13163921. PMID: 34439078; PMCID: PMC8394064.
7: Kakkassery V, Jünemann AM, Bechrakis NE, Grisanti S, Ranjbar M, Zschoche M, Heindl LM. Lymphom am Auge: Präzise Diagnostik und Klassifikation als Schlüssel einer erfolgreichen personalisierten Therapie [Ocular lymphoma : Precise diagnostics and classification as key for successful personalized treatment]. Ophthalmologe. 2020 Jun;117(6):499-507. German. doi: 10.1007/s00347-019-01020-5. PMID: 31811368.
8: Fend F, Süsskind D, Deuter C, Coupland SE. Maligne Lymphome des Auges[Malignant lymphomas of the eye]. Pathologe. 2017 Nov;38(6):515-520. German.doi: 10.1007/s00292-017-0378-6. PMID: 28993856.
9: Kakkassery V, Schroers R, Coupland SE, Wunderlich MI, Schargus M, Heinz C, Wasmuth S, Heiligenhaus A, Ahle G, Lenoble P, Schlegel U, Schmiegel W, Dick HB, Baraniskin A. Vitreous microRNA levels as diagnostic biomarkers for vitreoretinal lymphoma. Blood. 2017 Jun 8;129(23):3130-3133. doi: 10.1182/blood-2017-01-765180. PMID: 28389463.
10: Fend F, Ferreri AJ, Coupland SE. How we diagnose and treat vitreoretinallymphoma. Br J Haematol. 2016 Jun;173(5):680-92. doi: 10.1111/bjh.14025. Epub2016 May 2. Erratum in: Br J Haematol. 2018 Jun;181(5):712. doi:10.1111/bjh.15395. PMID: 27133587.
11: Bonzheim I, Giese S, Deuter C, Süsskind D, Zierhut M, Waizel M, Szurman P,Federmann B, Schmidt J, Quintanilla-Martinez L, Coupland SE, Bartz-Schmidt KU,Fend F. High frequency of MYD88 mutations in vitreoretinal B-cell lymphoma: avaluable tool to improve diagnostic yield of vitreous aspirates. Blood. 2015 Jul2;126(1):76-9. doi: 10.1182/blood-2015-01-620518. Epub 2015 Apr 21. PMID:25900979.
12: van den Brand M, Möbs M, Otto F, Kroeze LI, Gonzalez de Castro D,Stamatopoulos K, Davi F, Bravetti C, Kolijn PM, Vlachonikola E, Stewart JP, PottC, Hummel M, Darzentas N, Langerak AW, Fend F, Groenen PJTA. EuroClonality-NGSRecommendations for Evaluation of B-Cell Clonality Analysis by Next-GenerationSequencing: A Structured Approach with the DEPART Algorithm. J Mol Diagn. 2023Oct;25(10):729-739. doi: 10.1016/j.jmoldx.2023.06.011. Epub 2023 Jul 17. PMID:37467928.
13: van den Brand M, Rijntjes J, Möbs M, Steinhilber J, van der Klift MY, HeezenKC, Kroeze LI, Reigl T, Porc J, Darzentas N, Luijks JACW, Scheijen B, Davi F,ElDaly H, Liu H, Anagnostopoulos I, Hummel M, Fend F, Langerak AW, Groenen PJTA; EuroClonality-NGS Working Group. Next-Generation Sequencing-Based Clonality Assessment of Ig Gene Rearrangements: A Multicenter Validation Study byEuroClonality-NGS. J Mol Diagn. 2021 Sep;23(9):1105-1115. doi:10.1016/j.jmoldx.2021.06.005. Epub 2021 Jun 26. PMID: 34186174.
14: Scheijen B, Meijers RWJ, Rijntjes J, van der Klift MY, Möbs M, Steinhilber J,Reigl T, van den Brand M, Kotrová M, Ritter JM, Catherwood MA, Stamatopoulos K,Brüggemann M, Davi F, Darzentas N, Pott C, Fend F, Hummel M, Langerak AW,Groenen PJTA; EuroClonality-NGS Working Group. Next-generation sequencing ofimmunoglobulin gene rearrangements for clonality assessment: a technicalfeasibility study by EuroClonality-NGS. Leukemia. 2019 Sep;33(9):2227-2240. doi:10.1038/s41375-019-0508-7. Epub 2019 Jun 13. PMID: 31197258
Ob als Patient, Angehöriger, medizinischer Fachkollege oder Unterstützer: Ihre Mitwirkung und Ihr Interesse sind entscheidend für den Erfolg der DECODE VRL Studie.
Kontaktieren Sie uns, wenn Sie Fragen zur Studie, zur Teilnahme oder zu den wissenschaftlichen Hintergründen haben.
Liv Dollmann
Studienkoordination
Klinik für Augenheilkunde, Universitätsklinikum Schleswig-Holstein
Campus Lübeck
Tel.: +49 451 500-43911
E-Mail: liv.dollmann@uksh.de
Gemeinsam für eine bessere Diagnose und Behandlung des vitreoretinalen Lymphoms.
„Ihre Unterstützung bringt uns der Lösung einen Schritt näher, das Lymphom im Auge zu entschlüsseln“
